

نویسنده این موضوع
الکترونگاتیوی را میتوان به صورت یک خاصیت شیمیایی در توصیف توانایی اتم برای جذب الکترونها بیان کرد. به طور معمول، از روش «پاولینگ» (Pauling) برای بررسی مقدار الکترونگاتیوی عناصر استفاده میکنند. مقادیر الکترونگاتیوی که از این طریق به عناصر اختصاص مییابند، بدون بعد هستند. این امر، نشاندهنده طبیعت کیفی مقیاس الکترونگاتیوی است. در جدول زیر، الکترونگاتیوی عناصر را مشاهده میکنید.
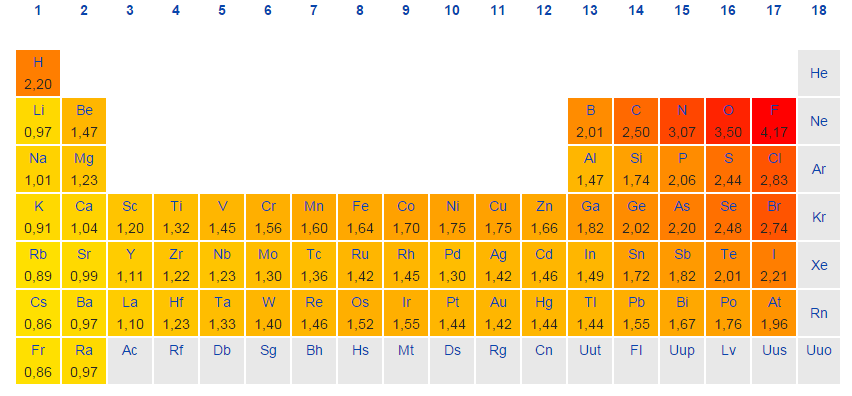
الکترونگاتیوی، تمایل اتم برای جذب الکترون و تشکیل پیوند را نشان میدهد. این خاصیت، به دلیل آرایش الکترونی اتمها بوجود میآید. بیشتر اتمها برای رسیدن به پایداری، از قاعده اکتت پیروی میکنند. از آنجایی که لایه ظرفیت عنصرهای سمت چپ جدول تناوبی، کمتر از نصف پر شده، انرژی مورد نیاز برای دریافت الکترون، به طور مشخصی بیشتر از انرژی مورد نیاز برای از دست دادن الکترون است. در نتیجه، به طور کلی، عناصر سمت چپ جدول تناوبی به هنگام تشکیل پیوند، الکترون از دست میدهند. به طور عکس، عناصر سمت راست جدول تناوبی، تمایل بیشتری برای دریافت الکترون و تکمیل لایه ظرفیت خود دارند. روندهای تناوبی الکترونگاتیوی را به صورت زیر میتوان بیان کرد:
در خصوص فلزات واسطه باید گفت که این عناصر، انحرافهایی از روند اصلی در هر تناوب و گروه از خود نشان میدهند که این انحرافات نیز به دلیل خواص فلزی است که بر جذب الکترونها تاثیر میگذارد. با توجه به دو روند اصلی که در خصوص الکترونگاتیوی وجود دارد، میتوان نتیجه گرفت که عنصر فلوئور، بالاترین الکترونگاتیوی را در میان عناصر جدول دارد.
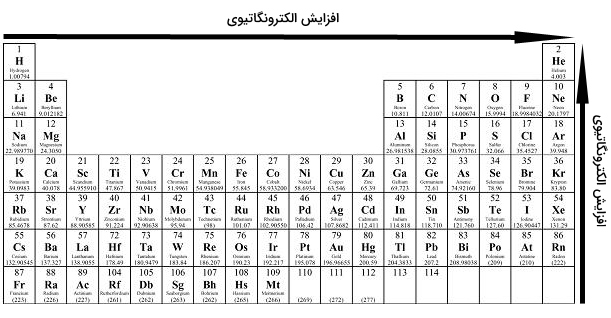

الکترونگاتیوی، تمایل اتم برای جذب الکترون و تشکیل پیوند را نشان میدهد. این خاصیت، به دلیل آرایش الکترونی اتمها بوجود میآید. بیشتر اتمها برای رسیدن به پایداری، از قاعده اکتت پیروی میکنند. از آنجایی که لایه ظرفیت عنصرهای سمت چپ جدول تناوبی، کمتر از نصف پر شده، انرژی مورد نیاز برای دریافت الکترون، به طور مشخصی بیشتر از انرژی مورد نیاز برای از دست دادن الکترون است. در نتیجه، به طور کلی، عناصر سمت چپ جدول تناوبی به هنگام تشکیل پیوند، الکترون از دست میدهند. به طور عکس، عناصر سمت راست جدول تناوبی، تمایل بیشتری برای دریافت الکترون و تکمیل لایه ظرفیت خود دارند. روندهای تناوبی الکترونگاتیوی را به صورت زیر میتوان بیان کرد:
- از چپ به راست در جدول تناوبی، الکترونگاتیوی افزایش پیدا میکند. اگر لایه ظرفیت یک اتم، کمتر از نصف پر شده باشد، انرژی کمتری برای از دست دادن الکترون و رسیدن به پایداری نیاز دارد. به عکس، اگر لایه ظرفیت، بیش از نصف پر شده باشد، دریافت الکترون، سادهتر خواهد بود.
- در هر گروه، از بالا به پایین، الکترونگاتیوی کاهش پیدا میکند. این امر به دلیل افزایش عدد اتمی در هر گروه از بالا به پایین و در نتیجه، افزایش فاصله بین الکترونهای ظرفیت و هسته و همچنین، افزایش شعاع اتمی اتفاق میافتد.
در خصوص فلزات واسطه باید گفت که این عناصر، انحرافهایی از روند اصلی در هر تناوب و گروه از خود نشان میدهند که این انحرافات نیز به دلیل خواص فلزی است که بر جذب الکترونها تاثیر میگذارد. با توجه به دو روند اصلی که در خصوص الکترونگاتیوی وجود دارد، میتوان نتیجه گرفت که عنصر فلوئور، بالاترین الکترونگاتیوی را در میان عناصر جدول دارد.

الکترونگاتیوی

رمان ۹۸ | دانلود رمان
نودهشتیا,بزرگترین مرجع تایپ رمان, دانلود رمان جدید,دانلود رمان عاشقانه, رمان خارجی, رمان ایرانی, دانلود رمان بدون سانسور,دانلود رمان اربابی,
 roman98.com
roman98.com
















